
Se
na eletrólise de um sal, um ácido ou uma base não considerarmos
ainda as reações secundárias, isto é, se considerarmos somente aquela
fase inicial em que os íons estão se deslocando para os eletrodos,
podemos dizer o seguinte.
|
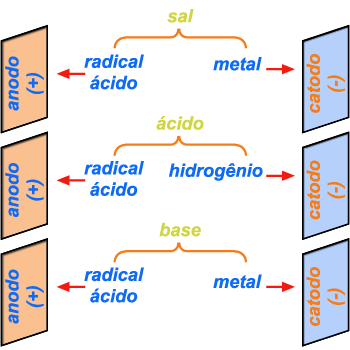 Figura 202 Figura 202 |

Uma
base sempre se dissocia em um íon metálico e o radical básico hidroxila
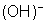 . Em outras palavras, a decomposição de uma base é análoga
à de um sal, na qual o radical ácido é substituído pelo radical
básico hidroxila. Por exemplo, o hidróxido de sódio se dissocia
no íon metálico
. Em outras palavras, a decomposição de uma base é análoga
à de um sal, na qual o radical ácido é substituído pelo radical
básico hidroxila. Por exemplo, o hidróxido de sódio se dissocia
no íon metálico
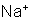 e na hidroxila
e na hidroxila
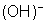 . Na eletrólise de uma base, o íon metálico se dirige sempre
para o cátodo, e a hidroxila para o anodo (fig. 202).
. Na eletrólise de uma base, o íon metálico se dirige sempre
para o cátodo, e a hidroxila para o anodo (fig. 202).
Vimos
então, que na eletrólise há decomposição de algum ácido, alguma
base ou algum sal, e depois, depósito de certas substâncias nos
eletrodos. Calculemos as massas dessas substâncias depositadas
nos eletrodos.
Antes
de uma substância se depositar em um eletrodo ela existe na solução
sob a forma de íon. Depois de chegar ao eletrodo o íon cede ou
retira elétrons, para se transformar no átomo da substância (neutro).
Seja
z a valência do íon do elemento considerado. A carga elétrica desse
íon será ze, como vimos no tópico "Carga
Eletrônica". Seja n o
número desses íons que chegam ao eletrodo durante certo tempo t.
Então, durante esse tempo, a carga elétrica que chega ao eletrodo
é:
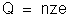
No
eletrodo se formam tantos átomos quantos são os íons que chegam,
isto é, no tempo t se formam n átomos. Sendo m a massa de um átomo,
a massa do elemento depositada durante o tempo t é:
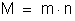
Sabemos
que o átomo-grama de qualquer elemento possui um número de átomos
igual ao número de Avogadro, que representaremos por N. Significa
que:
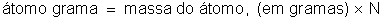
ou, chamando A ao átomo-grama do elemento, temos:
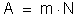
Tiramos
de
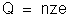 :
:
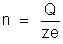
Tiramos
de
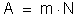 :
:
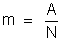
Substituindo
em
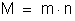 ,
teremos:
,
teremos:
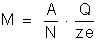
ou
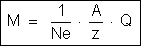

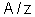 é o quociente do átomo-grama do elemento pela sua valência; é chamado
o equivalente químico do elemento. Nós o representaremos pela letra
a, isto é, faremos
é o quociente do átomo-grama do elemento pela sua valência; é chamado
o equivalente químico do elemento. Nós o representaremos pela letra
a, isto é, faremos

Como
a valência z é um número puro (não tem unidades), o equivalente
químico é uma grandeza da mesma espécie que A, isto é, massa e,
portanto, é avaliado em gramas.
O
produto
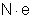 é o produto do número de Avogadro pela carga elétrica do
elétron. Como o número de Avogadro é um número puro (não tem unidades),
esse produto representa uma carga elétrica (é avaliado nas mesmas
unidades de e, isto é, em coulombs ou statcoulombs). Atualmente,
os valores admitidos para N e e
são:
é o produto do número de Avogadro pela carga elétrica do
elétron. Como o número de Avogadro é um número puro (não tem unidades),
esse produto representa uma carga elétrica (é avaliado nas mesmas
unidades de e, isto é, em coulombs ou statcoulombs). Atualmente,
os valores admitidos para N e e
são:
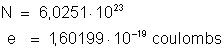
Então:
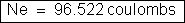
Essa
carga elétrica
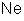 não depende, portanto, do elemento particular que está sendo
considerado na eletrólise, isto é, ela não depende do ácido, base
ou sal do qual estamos fazendo eletrólise. É portanto, uma constante
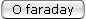
universal. Costuma-se representá-la pela letra F. É chamada um
faraday (não confundir com farad, que é unidade de capacidade).
não depende, portanto, do elemento particular que está sendo
considerado na eletrólise, isto é, ela não depende do ácido, base
ou sal do qual estamos fazendo eletrólise. É portanto, uma constante
universal. Costuma-se representá-la pela letra F. É chamada um
faraday (não confundir com farad, que é unidade de capacidade).
Portanto,
um faraday é a carga elétrica igual a 96.522 coulombs.

A
fórmula
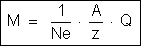 pode então ser escrita:
pode então ser escrita:
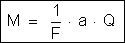
Essa
é a fórmula que permite calcular a massa de um elemento depositado
no anodo ou no cátodo. Ela resume as duas leis de Faraday.

Se
considerarmos que a carga elétrica é o produto da intensidade da
corrente pelo tempo, isto é,
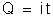 ,
,
podemos
escrever a fórmula
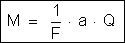 assim:
assim:
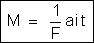
e
a 1a lei pode ser enunciada também do seguinte modo:
| “a massa
de qualquer elemento depositado em um dos eletrodos por efeito
da eletrólise é diretamente proporcional à intensidade da corrente
e ao tempo duranteo qual se da a eletrólise”. |


Se na
fórmula
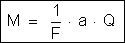 considerarmos
considerarmos
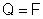 resultará:
resultará:
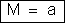
isto é:
a carga elétrica igual a um faraday faz depositar num eletrodo
uma massa de um elemento igual ao seu equivalente químico,
qualquer que seja o elemento. |

Na
fórmula:
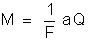 ou
ou

costuma-se
avaliar F em coulombs. Então a carga elétrica Q deve também ser
avaliada em coulombs e portanto, a corrente i, em ampères. A massa
M deve ser avaliada na mesma unidade que a (em geral gramas).

Chama-se
equivalente eletroquí-mico de um elemento ao quociente do seu equilivalente
químico pelo faraday. Representaremos por E, isto é,
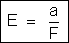
As
fórmulas
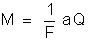 e
e
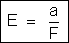 podem então ser escritas respectivamente:
podem então ser escritas respectivamente:

e
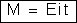
A
unidade de E é grama/coulomb.
Na
tabela seguinte damos o equivalente químico e o equivalente eletroquímico
de alguns elementos.
|
Elemento |
Massa atômica A |
Valência z |
Equivalente químico
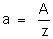
(gramas) |
Equivalente eletroquímico
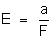
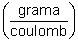
|
|
Prata |
107,88 |
1 |
107,88 |
0,00118000 |
|
Cobre |
63,57 |
2 |
31,785 |
0,0003294 |
|
Hidrogênio |
1,008 |
1 |
1,008 |
0,00001046 |
|
Oxigênio |
16,00 |
2 |
8,00 |
0,00008291 |
|
Cloro |
35,46 |
1 |
35,46 |
0,00036750 |
|
Chumbo |
207,20 |
2 |
103,60 |
0,00107307 |
|
Níquel |
58,69 |
2 |
29,35 |
0,00030400 |
|
Zinco |
65,38 |
2 |
32,69 |
0,0003385 |