
Dissolvamos
em água algumas gotas de um ácido, por exemplo, ácido clorídrico.
Introduzamos na solução dois eletrodos, ligados aos polos
de um gerador G. Quando começa a passar corrente, observamos
que na superfície dos eletrodos começam a desenvolver-se
pequenas bolhas gasosas, que vão crescendo, e ao atingirem
dimensões suficientes escapam pela superfície da solução.
Emborcando sobre os eletrodos duas provetas, podemos recolher
os gases, conforme indica a figura (fig. 200). Muito
facilmente reconhecemos que o gás que se desprende no cátodo
é hidrogênio; e o que se desprende no anodo é oxigênio.
Além disso, constatamos que as quantidades desses gases
são de dois volumes de hidrogênio para um volume de oxigênio.
Essa é a mesma relação que esses gases guardam na composição
da água. Concluímos então que a passagem da corrente elétrica
pela solução produziu a decomposição da água em seus componentes.
Em geral
se observa que, quando se faz passar corrente elétrica por
um eletrólito, dão-se reações químicas, por efeito das quais
se tem depósito de alguma substância no cátodo e de alguma
outra substância no anodo. Esse fenômeno, pelo qual se
dá reação química por causa da passagem de corrente pelo
eletrólito, é chamado ELETRÓLISE (“eletrólise” significa
“ruptura pela eletricidade”).
|
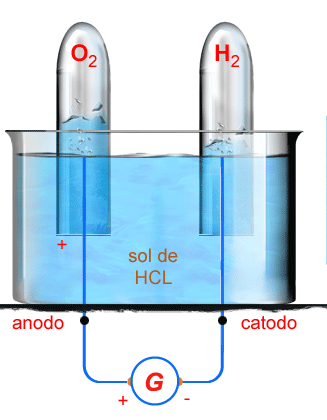 Figura 200 Figura 200 |
Os
aparelhos nos quais se estuda a eletrólise, que são constituídos
por uma cuba com os dois eletrodos, são chamados VOLTÂMETROS. A
figura 201 é a fotografia de um voltâmetro com os eletrodos
já soldados no fundo.
Veêm-se também duas provetas para recolhimento dos gases.
 Figura 201
Figura 201

O
fenômeno de eletrólise é complicado por causa de reações químicas
secundárias que se podem dar entre a água e as substâncias que se
depositam nos eletrodos por efeito da decomposição eletrolítica.
Assim, se passarmos uma corrente elétrica por uma solução de cloreto
de sódio, sabemos que há decomposição do cloreto de sódio em seus
componentes: sódio, que vai depositar-se sobre o cátodo, e cloro,
que vai depositar-se sobre o anodo. Mas, também neste caso, o que
observamos é que no cátodo se desprende hidrogênio, e no anodo se
desprende oxigênio, em vez de sódio e cloro respectivamente. A
explicação é a seguinte:
O
íon de sódio, que é positivo, ao chegar ao cátodo, que é negativo,
retira um eletrodo do cátodo e se torna um átomo, neutro, de sódio (veja fig. 199)
Esse sódio reage com a água segundo a equação:
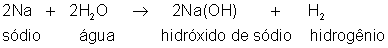
o
hidróxido de sódio fica dissolvido na água e o hidrogênio se desprende
do cátodo, porque é junto ao cátodo que se dá essa reação.
O
íon de cloro, que é negativo, ao chegar ao anodo, que é positivo,
cede um elétron ao anodo e se torna um átomo, neutro, de cloro.
Esse cloro reage com a água segundo a equação:
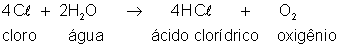
o
ácido clorídrico fica dissolvido na água, e o oxigênio se desprende
junto ao anodo.
Por
sua vez, o ácido clorídrico reage com o hidróxido de sódio segundo
a equação:
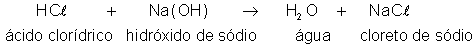
Essa
última reação recompõe então o cloreto de sódio que tinha se decomposto.
São
muito frequentes em eletrólise as reações secundárias entre a água
e as substâncias que se depositam nos eletrodos. Em muitos casos
essas reações secundárias tornam mais complexas as explicações dos
fenômenos.
1o) Explique
como deve se processar a eletrólise de uma solução de ácido sulfúrico
em água, mostrando inclusive quais as substâncias que são recolhidas
nos eletrodos.
2o) Suponha
que seja feita eletrólise de sulfato de cobre dissolvido em água,
num voltâmetro em que o anodo é de zinco e o cátodo de cobre. O
que acontece com o zinco e com o cobre?