
Para compreendermos
o significado da 2a lei de eletrólise, suponhamos um
conjunto de quatro voltâmetros ligados em série, conforme indica
a figura 203: o primeiro contendo uma solução de nitrato
de prata e eletrodos de prata; o segundo contendo uma solução de
sulfato de cobre e eletrodos de cobre; o terceiro contendo uma solução
de ácido clorídrico e eletrodos de platina; o quarto contendo uma
solução de ácido sulfúrico e eletrodos de platina. Nos diversos
eletrodos haverá deposição dos elementos indicados na figura. Como
as soluções estão em série, a carga elétrica que passa por todas
elas durante qualquer tempo é a mesma. Então as massas dos diversos
elementos depositados nos eletrodos são proporcionais aos seus equivalentes
químicos. Observando os equivalentes químicos dados na tabela acima,
concluímos que as massas depositadas obedecem às proporções:
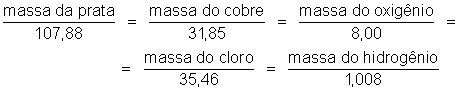
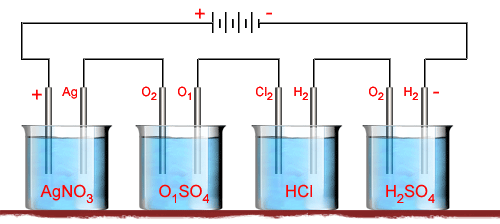
Figura 203