
Uma
prova experimental da dissociação eletrolítica é a seguinte:
Sabemos
que se dissolvermos em um litro d’água uma molécula-grama de açúcar,
ou de álcool, ou de qualquer outro corpo que não seja ácido, nem
base, nem sal, o ponto de solidificação da água baixa de 0oC
a
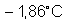 . (Fenômeno estudado em Crioscopia). O abaixamento dessa
temperatura depende exclusivamente do número de partículas dissolvidas.
E como a molécula-grama de qualquer corpo tem sempre o mesmo número
de moléculas, que é o número de Avogadro (
. (Fenômeno estudado em Crioscopia). O abaixamento dessa
temperatura depende exclusivamente do número de partículas dissolvidas.
E como a molécula-grama de qualquer corpo tem sempre o mesmo número
de moléculas, que é o número de Avogadro (
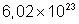 ), para todas as substâncias o número de moléculas dissolvidas
por molécula-grama é o mesmo, e por isso o abaixamento do ponto
de solidificação é independente da substância. Mas, se dissolvermos
em um litro d’água a molécula-grama de qualquer ácido, base ou sal,
a experiência mostra que o abaixamento do ponto de solidificação
é maior que 1,86oC, chegando em muitos casos a ser quase
o dobro desse. Ora, isso só se explica se o número de partículas
dissolvidas é maior. Mas, a molécula-grama dos ácidos, das bases
e dos sais também tem o mesmo número de moléculas que a molécula-grama
de qualquer outro corpo,
), para todas as substâncias o número de moléculas dissolvidas
por molécula-grama é o mesmo, e por isso o abaixamento do ponto
de solidificação é independente da substância. Mas, se dissolvermos
em um litro d’água a molécula-grama de qualquer ácido, base ou sal,
a experiência mostra que o abaixamento do ponto de solidificação
é maior que 1,86oC, chegando em muitos casos a ser quase
o dobro desse. Ora, isso só se explica se o número de partículas
dissolvidas é maior. Mas, a molécula-grama dos ácidos, das bases
e dos sais também tem o mesmo número de moléculas que a molécula-grama
de qualquer outro corpo,
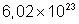 . O que acontece é que nessas soluções muitas moléculas
se desdobram em íons, aumentando assim o número de partículas existentes
na solução, e consequentemente baixando mais o ponto de solidificação.
. O que acontece é que nessas soluções muitas moléculas
se desdobram em íons, aumentando assim o número de partículas existentes
na solução, e consequentemente baixando mais o ponto de solidificação.