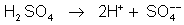A
explicação da condução da eletricidade pelas soluções de ácidos,
bases e sais em água foi dada pelo físico sueco Svante Arrhenius.
Tomemos como exemplo a solução de cloreto de sódio.
Um
átomo de sódio contém no núcleo 11 prótons e 12 neutrons; e ao redor
do núcleo, 11 elétrons dispostos em três órbitas, como mostra a
figura 196: 2 na órbita K, 8 na órbita L e 1 na órbita M.
A órbita M, mais externa, tem um só elétron, que está fracamente
ligado ao átomo e por isso pode sair do átomo com grande facilidade.
Se o átomo de sódio perder esse elétron, se transformará em um íon
positivo de sódio. Um íon positivo é chamado cátion.
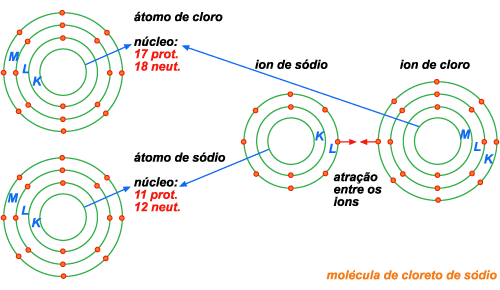
Figura 196
Um
átomo de cloro tem, no núcleo, 17 prótons e 18 neutrons; e ao redor
do núcleo, 17 elétrons, dispostos em três órbitas: 2 na órbita K,
8 na órbita L e 7 na órbita M. A órbita M de qualquer átomo pode
ter no máximo 8 elétrons. O átomo de cloro normalmente tem 7 elétrons
nessa órbita. Ele tem então possibilidade de captar um elétron
e se tornar um íon negativo de cloro. Um íon negativo é chamado
anion.
Muitos
alunos ainda pensam que a molécula de cloreto de sódio é formada
pela união de um átomo (neutro) de sódio com um átomo (neutro) de
cloro. Isso não é verdade. A molécula de cloreto de sódio é formada
pela união de um íon de sódio com um íon de cloro. O que acontece
é que como esses íons tem cargas elétricas de sinais opostos, eles
se atraem e constituem a molécula de cloreto de sódio.
Em
resumo: o que permite a formação da molécula é a força eletrostática
de atração dos dois íons que constituem a molécula.
Isso
acontece com qualquer molécula. Por exemplo, a molécula de sulfato
de cobre (
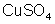 ) é formada pela atração do cátion de cobre (positivo) com
o anion
) é formada pela atração do cátion de cobre (positivo) com
o anion
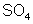 (negativo).
(negativo).

Vejamos
agora porque quando o cloreto de sódio está dissolvido em água ele
se comporta de modo diferente do que quando está seco e no ar.
Sabemos
da Eletrostática que a força de atração entre duas cargas elétricas
é inversamente proporcional à constante dielétrica do meio em que
estão as cargas. Ora, a constante dielétrica da água é 80 vezes
maior que a do ar ou do vácuo. Então, quando a molécula de cloreto
de sódio é colocada na água, a força de atração entre seus íons
fica 80 vezes menor do que quando ela está no ar. Essa força se
torna então pequena para manter os íons juntos. Como consequência,
quando a molécula de cloreto de sódio é colocada na água os íons
se separam. Essa separação dos íons que constituem a molécula é
chamada dissociação eletrolítica. Os íons separados ficam “vagando”
pela solução, sem uma direção determinada.
O
que dissemos para o caso do cloreto de sódio vale para qualquer
sal, qualquer ácido e qualquer base. Isto é, os sais, os ácidos
e as bases se dissociam quando dissolvidos na água.

Chama-se
valência de um cátion ao número de elétrons que faltam para que
ele se torne um átomo (neutro). Chama-se valência de um anion ao
número de elétrons que ele possui em excesso sobre o átomo (neutro).
Indica-se um cátion pelo mesmo símbolo do elemento químico correspondente,
colocando-se à direita e um pouco acima um número de sinais
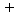 igual à sua valência. Exemplos: o cátion de sódio é indicado
por
igual à sua valência. Exemplos: o cátion de sódio é indicado
por
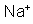 porque é monovalente; o cátion de cobre é indicado por
porque é monovalente; o cátion de cobre é indicado por
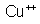 , porque é bivalente, etc.. Indica-se um anion pelo símbolo
do elemento químico correspondente, colocando-se à direita e um
pouco acima um número de sinais
, porque é bivalente, etc.. Indica-se um anion pelo símbolo
do elemento químico correspondente, colocando-se à direita e um
pouco acima um número de sinais
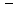 igual à sua valência. Exemplos: o anion de cloro é indicado
por
igual à sua valência. Exemplos: o anion de cloro é indicado
por
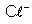 ; o anion de fluor é indicado por
; o anion de fluor é indicado por
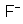 , etc..
, etc..
Para
indicar a dissociação eletrolítica das moléculas usamos equações
análogas às equações das reações químicas. Por exemplo, a dissociação
do cloreto de sódio é indicada assim:
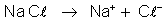
A
dissociação do hidróxido de potássio é indicada assim:
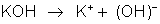
A
dissociação do ácido sulfúrico: