
Inicialmente
aparece uma diferença de potencial inicial devida ao mesmo fenômeno
que já estudamos na pilha de Volta: o zinco liberta íons positivos
de zinco na solução de sulfato de zinco, e retém elétrons, ficando
negativo em relação à solução. O cobre liberta íons positivos
de cobre, na solução de sulfato de cobre, e retém elétrons, ficando
negativo em relação à essa solução. Mas, o zinco liberta mais
íons do que o cobre, retendo mais elétrons. Por isso, o zinco
fica mais negativo que o cobre (fig. 215).

Figura 215

É
devida à ação dos sulfatos de cobre e de zinco.
a) Sulfato
de cobre
Este
sal se dissocia em íon de cobre e íon
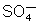 :
:
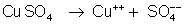
O
íon de cobre se dirige para o cobre; aí recebe elétrons que estão
chegando pelo condutor c e se transforma em átomo de cobre, ficando
no eletrodo de cobre. Este eletrodo vai crescendo à medida que
a pilha funciona.
O
íon
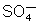 atravessa a parede porosa e se dirige para o zinco. Aí
reage com o zinco e produz sulfato de zinco, libertando-se dois
elétrons na reação:
atravessa a parede porosa e se dirige para o zinco. Aí
reage com o zinco e produz sulfato de zinco, libertando-se dois
elétrons na reação:
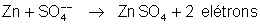
Esses
dois elétrons, o zinco os cede ao condutor c, que os transporta
para o cobre. O sulfato de zinco se dissolve. Do mesmo modo
que na pilha de Volta esta reação química é a fonte de elétrons
para a pilha de Daniell. É nessa reação que consiste a “transformação
da energia química em energia elétrica”. A energia provém da
transformação do zinco em sulfato de zinco. O zinco vai sendo
consumido.
b) Sulfato
de zinco
Este
sal se dissocia em íon de zinco e íon
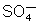 :
:
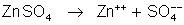
O
íon
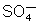 se dirige para o zinco, e reage com ele de acordo com
a equação
se dirige para o zinco, e reage com ele de acordo com
a equação 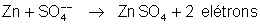 : forma-se mais sulfato de zinco, que se dissolve, e se libertam
mais dois elétrons.
: forma-se mais sulfato de zinco, que se dissolve, e se libertam
mais dois elétrons.
Quanto
aos íons de zinco,
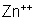 , alguns se unem novamente com íons
, alguns se unem novamente com íons
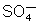 e reconstituem moléculas de sulfato de zinco. Mas, a
maioria deles permanece na solução sob a forma de íons. A medida
que a pilha funciona, o número de íons de zinco ao redor do eletrodo
de zinco vai aumentando. Como esse eletrodo é negativo e os íons
de zinco são positivos, o aumento da quantidade desses íons faz
diminuir a diferença de potencial entre o cobre e o zinco. À
medida que funciona, a pilha de Daniell piora. Veremos adiante,
no tópico "Polarização
das Pilhas" que esse fenômeno é chamado polarização.
e reconstituem moléculas de sulfato de zinco. Mas, a
maioria deles permanece na solução sob a forma de íons. A medida
que a pilha funciona, o número de íons de zinco ao redor do eletrodo
de zinco vai aumentando. Como esse eletrodo é negativo e os íons
de zinco são positivos, o aumento da quantidade desses íons faz
diminuir a diferença de potencial entre o cobre e o zinco. À
medida que funciona, a pilha de Daniell piora. Veremos adiante,
no tópico "Polarização
das Pilhas" que esse fenômeno é chamado polarização.