
No
funcionamento da pilha de Volta podemos distinguir duas fases:
1a) aparecimento de uma diferença de potencial inicial
entre o cobre e o zinco;
2a) manutenção dessa diferença de potencial.

Muitos
metais, quando colocados dentro d’água, soltam íons seus na água.
Assim, o zinco liberta, na solução de ácido sulfúrico, íons positivos
bivalentes de zinco,
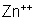 . Os dois elétrons que com esse íon formavam um átomo (neutro)
são retidos no eletrodo de zinco. Ao redor desse eletrodo ficam
então muitos íons positivos de zinco, e o eletrodo fica com um excesso
de elétrons (fig. 211).
. Os dois elétrons que com esse íon formavam um átomo (neutro)
são retidos no eletrodo de zinco. Ao redor desse eletrodo ficam
então muitos íons positivos de zinco, e o eletrodo fica com um excesso
de elétrons (fig. 211).

Figura 211
A
libertação de íons de zinco não continua indefinidamente, porque
a carga positiva dos íons que contornam esse eletrodo atingem valor
tal que impede a libertação de novos íons; isto é, qualquer novo
íon solto na solução é repelido pela carga positiva e volta ao zinco,
aí se unindo a dois elétrons e formando novamente um átomo de zinco
(neutro).
O
zinco fica então com carga negativa, devida aos elétrons, e a solução
com carga positiva, devida aos íons. A consequêncta é que o zinco
fica com um potencial mais baixo que a solução.
Com
a lâmina de cobre acontece o mesmo. Ela também solta na solução
íons positivos bivalentes de cobre, e retém elétrons (fig. 211). Então, o
cobre também fica com potencial mais baixo que a solução.
Mas,
os metais não tem todos a mesma facilidade para soltar íons. O
cobre solta menos íons que o zinco e, portanto, retém menos elétrons
que o zinco. A consequência é que o cobre fica com potencial mais
alto que o zinco, embora ambos tenham potencial mais baixo que a
solução. Esses potenciais estão esquematizados na figura abaixo.

Figura 212
A
diferença de potencial entre o cobre e o zinco aparece então porque
esses dois metais não tem a mesma facilidade para libertar íons
na solução.
Sentido
da corrente elétrica
Como
o zinco possui mais elétrons que o cobre, quando eles são reunidos
pelo condutor c há passagem de elétrons do zinco para o cobre, isto
é, carga negativa, do zinco para o cobre. Mas, convencionamos que
a corrente nos metais seja constituída por movimento de partículas
positivas imaginárias que se desloquem do cobre para o zinco.

Poderíamos
levantar a seguinte dúvida: se o zinco vai cedendo elétrons ao cobre,
através do condutor c, depois de algum tempo o zinco e o cobre ficarão
com igual número de elétrons, e portanto, ao mesmo potencial, e
a pilha deixará de funcionar. Veremos que o ácido sulfúrico impede
que isso aconteça.
As
moléculas de ácido sulfúrico se dissociam em íons hidrogênio e
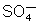 , segundo a equação:
, segundo a equação:
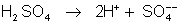
O
íon
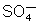 se dirige para o zinco, aí reage com ele, formando-se sulfato
de zinco, segundo a equação:
se dirige para o zinco, aí reage com ele, formando-se sulfato
de zinco, segundo a equação:
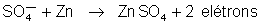
libertando-se
nessa reação dois elétrons que o zinco manda depois para o condutor
c. Essa reação química é a fonte de elétrons para o zinco, isto
é, é a origem dos elétrons que a pilha fornece para constituírem
a corrente elétrica no circuito externo.
O
íon de hidrogênio,
 , se dirige para o cobre; aí recebe um elétron e se transforma
num átomo de hidrogênio (neutro), segundo a equaçao:
, se dirige para o cobre; aí recebe um elétron e se transforma
num átomo de hidrogênio (neutro), segundo a equaçao:
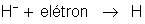
Os
átomos de hidrogênio se unem dois a dois formando moléculas de hidrogênio,
que se desprendem junto ao cobre. Em resumo: a reação química
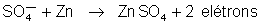 fornece elétrons ao zinco; este os cede ao condutor c, que os conduz
até o cobre; o cobre recebe elétrons e os cede aos íons de hidrogênio.
fornece elétrons ao zinco; este os cede ao condutor c, que os conduz
até o cobre; o cobre recebe elétrons e os cede aos íons de hidrogênio.
Energia
transformada na pilha
Agora
podemos compreender claramente o que significa a expressão: “a pilha
transforma energia química em energia elétrica”. Significa que
a reação química
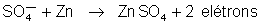 liberta dois elétrons, isto é, liberta carga elétrica.
liberta dois elétrons, isto é, liberta carga elétrica.
Com
o funcionamento da pilha, a reação
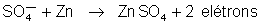 continua, e o zinco vai sendo consumido, e transformado em sulfato
de zinco. Podemos então, dizer que a energia elétrica fornecida
pela pilha provém da energia química do consumo do zinco. Depois
de algum tempo de uso, o zinco desaparece. Para restaurar a pilha
precisamos usar nova lâmina de zinco.
continua, e o zinco vai sendo consumido, e transformado em sulfato
de zinco. Podemos então, dizer que a energia elétrica fornecida
pela pilha provém da energia química do consumo do zinco. Depois
de algum tempo de uso, o zinco desaparece. Para restaurar a pilha
precisamos usar nova lâmina de zinco.

Podemos
resumir o funcionamento da pilha de Volta do seguinte modo:
inicialmente se estabelece uma diferença de potencial entre
o cobre e o zinco, provocada pelo fato de esses dois metais
não terem a mesma facilidade para libertar íons na água. Depois,
os íons
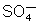 e
e
 permitem que a diferença de potencial se mantenha.
permitem que a diferença de potencial se mantenha. |

1a) Vemos
que não é possível construir-se uma pilha com água pura, pois,
sem a presença dos íons que provocam reações químicas, a diferença
de potencial inicial não se mantém.
2a) Concluímos
também que na construção de uma pilha podemos usar dois metais
quaisquer, contanto que eles não tenham a mesma facilidade
para soltar íons. |

