
Nota: Todos
os problemas sobre eletrólise se reduzem à aplicação da fórmula:
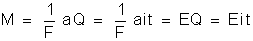
na qual
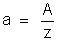 e
e
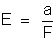
|
1. a) Qual
a massa de prata depositada no cátodo por uma carga de 10.000 coulombs
ao atravessar uma solução de nitrato de prata? b) Sabendo que a
eletrólise demorou uma hora, qual a intensidade da corrente? O equivalente
químico da prata é 107,88G.
a) A massa de
prata depositada é dada por:
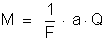 ,
,
em que:
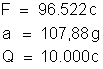
Resulta:
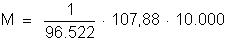
ou
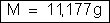
b) A intensidade
da corrente é dada por:
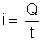 , em que:
, em que:
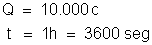
Resulta:
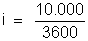 ou
ou
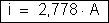
2. Por uma
solução de sulfato de cobre passa uma corrente de 10 ampères durante
meia hora. Calcular: a) a massa de cobre depositada no cátado;
b) a massa de sulfato de cobre decomposta. Dados: massa atômica
do cobre, 63,57; valência, 2; massa atômica do oxigênio, 16 e a do
enxofre, 32.

a) A massa de
cobre decomposta é dada por:
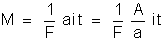 ,
,
em que:
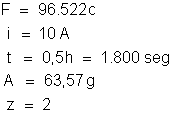
Resulta:
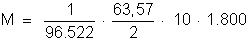 ou
ou
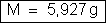
b) A massa molecular
do sulfato de cobre,
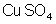 , é:
, é:
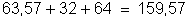
Podemos estabelecer
a seguinte proporção:
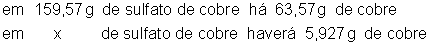
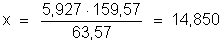
Portanto, foram
decompostas 14,850g de sulfato de cobre.
3. Na eletrólise
de uma solução de sulfato de níquel, com uma corrente de um ampère,
quanto tempo é necessário para se formar um depósito de uma grama
de níquel? Dados para o níquel:
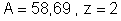 .
.
4. A eletrólise
de um sal de certo elemento bivalente durou meia hora com uma corrente
de 5 ampères. Durante esse tempo se formou no cátodo um depósito
de 2,736 gramas do elemento. a) Qual a massa atômica do elemento?
b) Qual o seu equivalente químico? c) Qual o seu equivalente
eletroquímico?
5. Para purificação
de cobre faz-se eletrólise de uma solução de sulfato de cobre, conforme
está indicado na figura abaixo, utilizando-se uma corrente de
10.000 ampères de um gerador de força eletromotriz de 5 volts.
Calcular: a) que massa de cobre puro se deposita em um segundo;
b) que massa de cobre puro se deposita em uma hora; c) qual
o tempo necessário para purificar uma tonelada de cobre; d) qual
a potência do gerador que está fornecendo corrente. Massa atômica
do cobre, 63,57 e valência, 2.
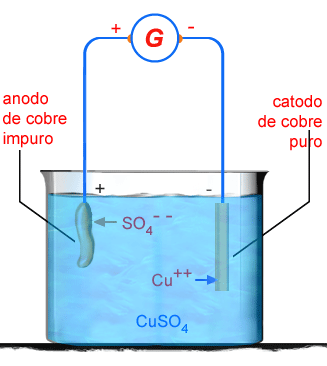
Figura 205
Nota: Pedimos
ao leitor se deter um pouco sobre os resultados deste problema, porque
é um problema real.
6. São ligados
em série quatro voltâmetros: um, contendo uma solução de nitrato de
prata e eletrodos de prata; outro, com uma solução de sulfato de cobre
e eletrodos de cobre; o terceiro, com uma solução de ácido clorídrico
e eletrodos de platina; o quarto, com uma solução de ácido sulfúrico
e eletrodos de platina, como indica a figura abixo. Observa-se
que depois de certo tempo se depositou, no cátado do primeiro voltâmetro,
15 gramas de prata. Pergunta-se: a) quantas gramas de oxigênio,
de cobre, de cloro e de hidrogênio são libertadas durante o mesmo
tempo? b) Quantas gramas de nitrato de prata, de sulfato de
cobre, de ácido clorídrico e de ácido sulfúrico são decompostas durante
esse tempo? c) Qual a carga elétrica que passa pelas soluções
durante o mesmo tempo?
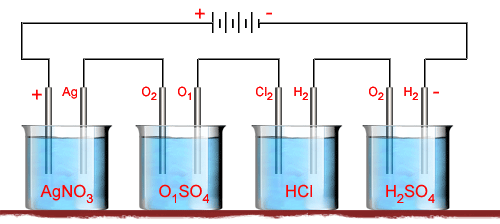
Figura 203
Dados: massa
atômica da prata, 107,88; valência, 1; massa atômica do cobre, 63,57;
valência, 2; massa atômica do cloro, 35,46, valência, 1; massa atômica
do oxigênio, 16; valência, 2; massa atômica do hidrogênio, 1,008;
valência, 1; massa atômica do nitrogênio, 14; do enxofre, 32.
7. Um voltâmetro
que contém uma solução de sulfato de níquel e cátodo de níquel é ligado
em série com uma resistência de
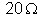 , e um gerador de f.e.m. 12v e resistência interna desprezível.
A resistência de
, e um gerador de f.e.m. 12v e resistência interna desprezível.
A resistência de
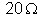 dissipa uma potência de 5w. Pergunta-se: a) a intensidade
da corrente; b) o tempo necessário para depositar no cátodo
0,076g de níquel; c) a carga elétrica que passa pela solução
durante esse tempo; d) a resistência da solução contida no voltâmetro.
dissipa uma potência de 5w. Pergunta-se: a) a intensidade
da corrente; b) o tempo necessário para depositar no cátodo
0,076g de níquel; c) a carga elétrica que passa pela solução
durante esse tempo; d) a resistência da solução contida no voltâmetro.
Dados para o níquel:
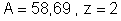 .
.
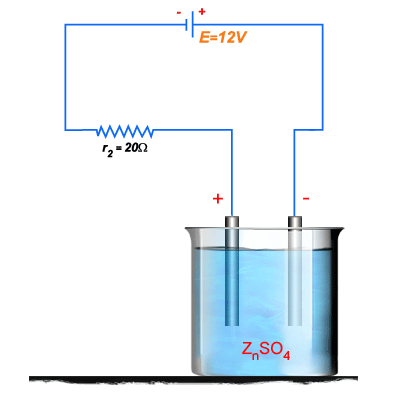
Figura 206
8. Para se aferir
um miliamperímetro ele foi ligado em série com um voltâmetro que continha
solução de sulfato de cobre e cátodo de cobre. Durante 1000 minutos
se fez passar uma corrente que o miliamperímetro marcava como sendo
de 20 miliampères. Observou-se que durante aquele tempo se depositaram
no cátodo 0,4149g de cobre. a) Faça uma figura das ligações;
b) Qual a intensidade verdadeira da corrente que passou? c) Qual
o erro do miliamperímetro?
Para o cobre,
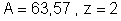 .
.
9. Uma resistência
de
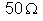 é ligada em paralelo com um voltâmetro de eletrodos de platina,
que contém uma solução de ácido clorídrico. Os dois são ligados à
um gerador de f.e.m. desconhecida e resistência interna desprezível,
como indica a figura 207. Pela resistência passa uma corrente
é ligada em paralelo com um voltâmetro de eletrodos de platina,
que contém uma solução de ácido clorídrico. Os dois são ligados à
um gerador de f.e.m. desconhecida e resistência interna desprezível,
como indica a figura 207. Pela resistência passa uma corrente
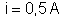 . Depois de o circuito ligado durante meia hora, se observou
que do anodo do voltâmetro se haviam desprendido 1,322g de cloro.
Calcular: a) a corrente que passa pelo voltâmetro; b) a
corrente total; c) a carga elétrica que passa pelo voltâmtro
durante meia hora; d) a resistência da solução; e) a resistência
elétrica total do circuito; f) a f.e.m. do gerador; g) a
potência do gerador. A massa atômica do cloro é 35,46 e a valência
é 1.
. Depois de o circuito ligado durante meia hora, se observou
que do anodo do voltâmetro se haviam desprendido 1,322g de cloro.
Calcular: a) a corrente que passa pelo voltâmetro; b) a
corrente total; c) a carga elétrica que passa pelo voltâmtro
durante meia hora; d) a resistência da solução; e) a resistência
elétrica total do circuito; f) a f.e.m. do gerador; g) a
potência do gerador. A massa atômica do cloro é 35,46 e a valência
é 1.
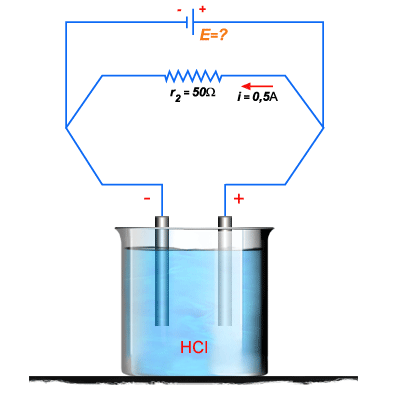
Figura 207
10. Entre os
terminais B e C de um gerador são ligados: um voltímetro V, cuja resistência
pode ser considerada infinitamente grande e que marca uma diferença
de potencial de 6v; uma resistência desconhecida r, em série com um
amperímetro A de resistência interna
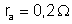 , que marca uma corrente de 2A; um voltâmetro que contém uma
solução de nitrato de prata (fig. 208). Depois de 20 minutos
se observa que num dos eletrodos do voltâmetro se depositam 4,023g
de prata. Pergunta-se: a) a corrente total fornecida pelo gerador;
b) a resistência total entre B e C ; c) a f.e.m.
do gerador, considerando-se que sua resistência interna é desprezível.
A massa atômica da prata é 107,88 e a valência é 1.
, que marca uma corrente de 2A; um voltâmetro que contém uma
solução de nitrato de prata (fig. 208). Depois de 20 minutos
se observa que num dos eletrodos do voltâmetro se depositam 4,023g
de prata. Pergunta-se: a) a corrente total fornecida pelo gerador;
b) a resistência total entre B e C ; c) a f.e.m.
do gerador, considerando-se que sua resistência interna é desprezível.
A massa atômica da prata é 107,88 e a valência é 1.

Figura 208
11. São colocados
em série dois voltâmetros: um contendo uma solução de nitrato de prata,
outro com uma solução de sulfato de chumbo. Medindo-se a massa da
prata depositada durante certo tempo se concluiu que a intensidade
da corrente que circulou pelos voltâmetros é de um ampère internacional.
Pergunta-se: a) qual a relação entre a massa de chumbo e a de
prata depositadas durante o mesmo tempo? b) Qual a massa de
chumbo depositada em um segundo? A prata tem
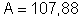 e
e
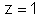 ; o chumbo tem
; o chumbo tem
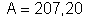 e
e
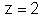 .
.
Sugestão: Para
resolver êste problema, recorde a definição de ampère internacional.
12. Quer-se
pratear um objeto de área
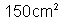 cobrindo-o com uma camada de prata de 0,1mm de espessura.
Utilizando-se uma corrente de dois ampères, quanto tempo deve demorar
a eletrólise? Densidade da prata
cobrindo-o com uma camada de prata de 0,1mm de espessura.
Utilizando-se uma corrente de dois ampères, quanto tempo deve demorar
a eletrólise? Densidade da prata
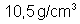 , massa atômica 107,88 e valência 1.
, massa atômica 107,88 e valência 1.
13. Na eletrólise
de uma solução de sulfato de cobre observa-se que há depósito de 0,9858g
de cobre no cátado, durante 10 minutos. Calcular: a) a carga
elétrica que circulou durante 10 minutos; b) a intensidade da
corrente; c) o número de íons de cobre que chegaram ao cátodo
durante os 10 minutos; d) usando exclusivamente elementos deste
problema, calcular a massa de um átomo de cobre, em gramas.
Dados: massa atômica do cobre, 63,57; valência 2; carga elétrica
do elétron,
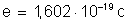 .
.
14. Sabendo que
a carga elétrica de um életron é:
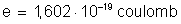 , quantos elétrons são necessários para formar uma carga elétrica
igual a um coulomb?
, quantos elétrons são necessários para formar uma carga elétrica
igual a um coulomb?
15. Sabendo que
o número de Avogadro é:
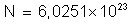 e que a massa atômica do cobre é 63,57, calcular a massa de
um átomo de cobre, em gramas, e comparar com a resposta d do problema
13.
e que a massa atômica do cobre é 63,57, calcular a massa de
um átomo de cobre, em gramas, e comparar com a resposta d do problema
13.
16. Se o leitor
dispuser de um acumulador (por exemplo, um acumulador de automóvel),
ou de uma associação de duas ou três pilhas que dêem 6 vols,
realize em sua casa experiências sobre eletrólise, que são muito simples.
Por exemplo, use uma solução de cloreto de sódio (sal de cozinha)
em água (se quiser fazer solução de ácido sulfúrico, coloque, gota
a gota, ácido sulfúrico na água, e não água no ácido, pois isto é
perigoso).
17. Realize
a experiência descrita com a figura abaixo.
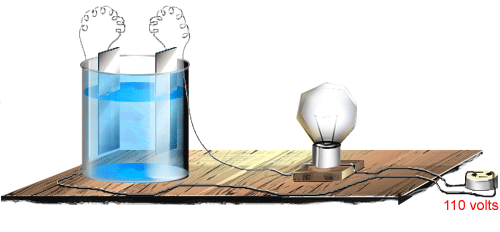
Figura 195
18. Observe
a figura abaixo e indique qual a diferença entre um átomo de
sódio e um íon de sódio, e entre um átomo de cloro e um íon de cloro.
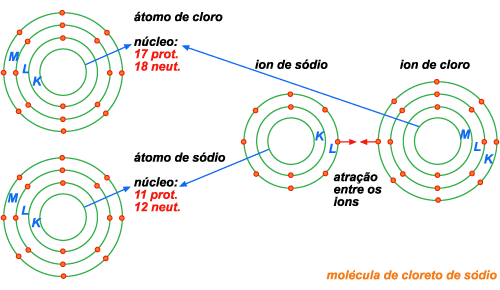
Figura 196
19. Qual
dos elementos da Tabela é depositado em
maior quantidade numa eletrólise, para a mesma carga elétrica? Por
que?
20. Defina:
eletrólito, não-eletrólito, íon, cátion, anion.
21. Explique
a formação da molécula de cloreto de sódio.
22. O que é dissociação
eletrolítica?
23. O que é valência
de um íon?
24. Descreva uma
prova experimental da dissociação eletrolítica.
25. Explique
o mecanismo da condução elétrica pelos eletrólitos.
26. Como
se constitui o circuito elétrico fechado na condução eletrolítica?
27. Por que a
carga do elétron é chamada átomo de eletricidade?
28. Que relação
há entre a carga de um íon e a carga eletrônica?
29. O que é eletrólise?
Descreva alguma experiência de eletrólise.
31. Qual
a diferença entre dissociação eletrolítica e eletrólise?
32. Descreva
as eletrólises de soluções das seguintes substâncias, indicando inclusive
quais as substâncias que se desprendem no cátado: cloreto de sódio,
ácido clorídrico, sulfato de cobre, ácido sulfúrico.
33. Explique
em que sentido se deslocam os íons na eletrólise de um ácido, de uma
base e de um sal.
34. Deduza as
leis de Faraday sobre eletrólise.
35. Defina equivalente
químico e equivalente eletroquímico de um elemento. Quais suas unidades?
36. O que
é um faraday? E um farad?
37. Que massa
de um elemento é depositada pela carga elétrica de um faraday? Prove.
38. Qual
a relação entre o número de Avogadro e o faraday? (Essa relação é
das mais importantes da Física).
39. Defina
ampère internacional e coulomb internacional.
40. O que
é galvanosplatia? Dê exemplo.
41. Como se fazem
as matrizes tipográficas de cobre?
42. Como
se refina o cobre por processo eletrolítico?
43. Como
se faz a extração industrial do alumínio por meio da criolita e da
bauxita?
44. Explique
como se pode calcular, por uma experiência de eletrólise, a massa
de um elemento de valência z (veja, por exemplo, tópico "Medida
de Massa de um Átomo" e o problema 13).
Autor:
Roberto A. Salmeron