
Quando estudamos um determinado assunto por livros didáticos,
temos a impressão de que a descoberta dos fenômenos e das leis
foram feitas de maneira muito ordenada e sistemática, como são
apresentadas nesses livros. A exposição didática, em geral, nos
deixa com a impressão de que um cientista isolado desenvolveu
muito suavemente um raciocínio e chegou a muitas conclusões.
Mas, a realidade é diferente. Todas as descobertas, que em geral
levam o nome de um único homem, são o resultado do trabalho de
muitos homens. Dos homens que construíram a história dessas descobertas,
e que não aparecem. Os estudos relativos à eletrólise são um
bom exemplo do que estamos afirmando. As suas leis fundamentais,
que atualmente podem ser compreendidas por qualquer estudante
de curso secundário em poucas horas, são o resultado de trabalhos
de quase um século, executados por vários indivíduos em condições
e lugares diferentes.
Pouco tempo depois
que se descobriu a corrente elétrica, alguns físicos observaram
que certas soluções são condutoras de eletricidade. Somente depois
dos trabalhos de vários investigadores, Faraday, em 1833, descobriu
as leis que levam o seu nome. Ele não fez nenhuma teoria a respeito
do fenômeno, porque os conhecimentos daquela época eram muito deficientes.
Faraday foi o primeiro a usar o termo “eletrólise”. Em 1857, Clausius
fez uma teoria a respeito da eletrólise, mas falha. Em 1880, Helmoltz
iniciou a teoria da dissociação eletrolítica, que foi continuada
por Arrhenius. Este, somente em 1887 completou sua teoria, a respeito
da dissociação eletrolítica e da eletrólise, que constitui a base
das idéias atuais que temos sobre o fenômeno.
Para
que se tenha uma idéia do esforço e da visão daqueles homens basta
observar que as explicações que demos neste capítulo sobre eletrólise
envolvem sempre o conceito de elétron e de carga do elétron.
E, no entanto, o elétron somente foi descoberto em 1897, isto
é, 10 anos depois da teoria de Arrhenius e 64 anos depois que
Faraday descobriu as leis da eletrólise! Tendo um conceito de
íon dado pela Química, e não pela Física, sem estar ao par de
muitos fenômenos físicos, aqueles homens chegaram a leis quantitativas
exatas, exclusivamente com dados experimentais, embora não soubessem
justificar essas leis. Assim, por exemplo, a constante F, o faraday,
naquela época era um simples número que Faraday tinha obtido experimentalmente,
mas, ninguém sabia o que significava e porque é constante. Hoje
sabemos que é o produto do número de Avogadro pela carga do elétron.
E a expressão
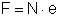 é uma das fundamentais em Física Atômica, porque N e e
são duas grandezas muito importantes.
é uma das fundamentais em Física Atômica, porque N e e
são duas grandezas muito importantes.