
Além da construção
de pilhas e acumuladores, que estudaremos no Capítulo
11, as aplicações da eletrólise na indústria são muito numerosas
e importantes. Veremos as aplicações em galvanoplastia, as fabricações
de matrizes tipográficas, a refinação do cobre e a extração comercial
do alumínio.
Quase todas
as aplicações industriais da eletrólise se baseiam no seguinte fato:
quando fazemos eletrólise de um sal de certo metal, esse metal se
deposita sempre no cátodo.

Todos sabem
que é muito comum cobrir-se um objeto de metal barato com uma camada
fina de um metal caro. É o caso dos objetos dourados, prateados,
niquelados, cromados, etc.. Essa operação é feita por eletrólise
e é chamada galvanoplastia.
Para se depositar
um metal determinado sobre um objeto faz-se o seguinte: prepara-se
uma solução de um sal desse metal. O sal se dissocia em um radical
ácido mais um íon metálico. Usa-se como anodo uma barra desse metal,
e como cátodo o próprio objeto sobre o qual o metal deve ser depositado.
O anodo é ligado ao polo positivo de um gerador de uns 5 ou 6 volts,
e o objeto é ligado ao polo negativo. Quando passa corrente, o
íon metálico, que é positivo, se dirige para o cátodo, que é o próprio
objeto a ser coberto, e se deposita nesse objeto. O íon ácido que
é negativo, se dirige para o anodo: aí reage com o metal e forma
novamente o sal primitivo.

Suponhamos
que desejamos pratear uma colher. Usamos a própria colher
como cátodo, e como anodo usamos uma barra de prata. O
eletrólito pode ser uma solução de nitrato de prata, que
se dissocia assim:
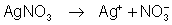
Quando
passa corrente, o íon
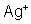 se desloca para o cátodo e aí se deposita sobre
a colher. O íon
se desloca para o cátodo e aí se deposita sobre
a colher. O íon
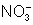 se desloca para o anodo: aí reage com a prata e
forma novamente o nitrato de prata.
se desloca para o anodo: aí reage com a prata e
forma novamente o nitrato de prata.
|
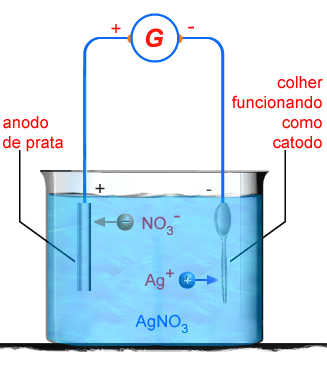 Figura 204 Figura 204 |

Muitas vezes
nas tipografias se faz por eletrólise uma “matriz” de cobre de uma
página a ser impressa. Inicialmente se prepara a matriz com os
tipos comuns de tipografia. Depois se tira dessa matriz um molde
de cera, em baixo-relevo. Como a cera não é condutora, ela é recoberta
por uma camada de grafite, que é condutor. A cera, assim preparada
é usada como cátodo, numa eletrólise de um sal de cobre, sendo o
anodo de cobre. Como os íons de cobre são positivos, eles vão se
depositar sobre a cera, e reproduz-se assim, em cobre, a matriz
primitiva. Essa matriz de cobre tem, mais ou menos, a espessura
de um cartão de visitas. Esse processo é vantajoso nas grandes
tipografias, em que são feitas tiragens grandes de livros, porque
assim, com um número relativamente pequeno de tipos, se fazem as
matrizes, e quando ficam prontas as matrizes de cobre, os tipos
podem ser usados para o preparo de outras matrizes.

O cobre
que provem das fundições possui de 1% a 5% de impurezas,
e por causa disso não pode ser usado para certas finalidades,
como por exemplo, fios condutores de eletricidade. Ele
é então purificado por eletrólise, atingindo um grau de
pureza de 99,95%. Assim purificado é conhecido no comércio
como cobre eletrolítico.
Faz-se
uma solução de sulfato de cobre que se dissocia assim:
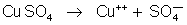
O cobre
impuro é usado como anodo. O cátodo é uma lâmina fina de
cobre já puro (fig. 205). Quando passa corrente, o cátion de cobre
se deposita sobre o cátodo, que vai então se avolumando.
O íon
 reage com o cobre do anodo, formando novamente sulfato
de cobre, que se dissocia, e o processo continua. O cátodo
ficará sendo então cobre puro.
reage com o cobre do anodo, formando novamente sulfato
de cobre, que se dissocia, e o processo continua. O cátodo
ficará sendo então cobre puro.
|
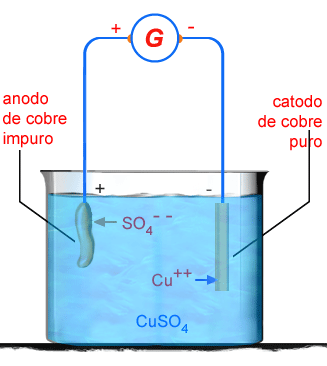
Figura 205 |

O processo de
obtenção do alumínio usado atualmente é o seguinte. Funde-se um
mineral de alumínio chamado criolita, que fica à temperatura de
900oC. Depois se dissolve na criolita o óxido de alumínio
(
 ), chamado alumina. O eletrólito é, então, constituído pelo
óxido de alumínio dissolvido em criolita fundida. Faz-se passar
pela solução uma corrente de uns 10.000 ampères, sob diferença de
potencial de 5,5 volts. O óxido de alumínio é dissolvido no
banho de criolita fundida, e a corrente o separa nos seus constituintes:
alumínio e oxigênio.
), chamado alumina. O eletrólito é, então, constituído pelo
óxido de alumínio dissolvido em criolita fundida. Faz-se passar
pela solução uma corrente de uns 10.000 ampères, sob diferença de
potencial de 5,5 volts. O óxido de alumínio é dissolvido no
banho de criolita fundida, e a corrente o separa nos seus constituintes:
alumínio e oxigênio.
Este processo
de obtenção do alumínio foi inventado em 1886. Para que se tenha
uma idéia da repercussão econômica que essa técnica teve, basta
dizer que antes daquela data o alumínio custava vinte vezes mais
do que custa hoje. Foi esse processo que permitiu que o alumínio
tivesse a grande aplicação que todos conhecem.
O óxido de alumínio
necessário para êste processo é encontrado em grande grau de pureza
num mineral de alumínio chamado bauxita. O Brasil é riquíssimo
em bauxita, e poderia ser um grande produtor de alumínio, se suas
condições econômicas permitissem.